Kamu pernah makan jeruk? Pernah dong yaa, dan rasanya itu ada asam-asamnya gitu kan? karena jeruk tersebut mengandung senyawa asam. Terus pernah nggak lagi sabunan terus nggak sengaja sabunnya nyiprat ke mulut, terus kejilat? Rasanya pahit kan? Itu karena sabun mengandung senyawa basa. Lalu, apa saja sih sifat dan klasifikasi asam basa?
A. Asam
Pengertian Asam adalah Asam dalam ilmu kimia ialah senyawa kimia yang jika dilarutkan dalam air akan menghasilkan sebuah larutan dengan pH lebih kecil dari 7. Dalam definisi modern, asam yaitu suatu zat yang bisa memberi proton (ion H+) kepada zat lain (yang disebut basa), atau bisa menerima pasangan elektron bebas dari suatu basa.
Istilah asam (acid) berasal dari bahasa Latin acetum yang berarti cuka. Di alam, asam ditemukan dalam buah-buahan, misalnya asam sitrat dalam buah jeruk berfungsi untuk memberi rasa limun yang tajam.
Cuka mengandung asam asetat, dan asam tanak dari kulit pohon digunakan untuk menyamak kulit. Asam mineral yang lebih kuat telah dibuat sejak abad pertengahan, salah satunya adalah aqua forti (asam nitrat) yang digunakan oleh para peneliti untuk memisahkan emas dan perak.
Sebagian besar buah-buahan mengandung asam organik lemah, seperti asam sitrat pada jeruk, asam maleat pada anggur hijau, juga asam tatrat yang menjadi bahan vitamin C dan banyak terdapat dalam buah lemon. Asam ini baik lho untuk meningkatkan daya tahan tubuh. Makanan asam juga sangat baik untuk ibu-ibu yang sedang hamil, karena makanan asam itu baik untuk penyerapan zat besi, terus juga dapat membantu pembentukan hemoglobin.
Senyawa Asam terbagi 2 yakni Asam kuat dan Asam Lemah
Asam kuat adalah senyawa yang terurai secara keseluruhan saat di larutkan di dalam air dan menghasilkan jumlah ion seluruhnya.
Contohnya: HCL, HNO3, H2SO4, HCIO4
Asam lemah adalah senyawa yang sedikit terurai saat dilarutkan di dalam air.
Contohnya: H3PO4, H2SO3, HNO2, CH3COOH
B. Basa
Istilah basa (alkali) berasal dari bahasa Arab yang berarti abu.
Sifat basa pada umumnya ditunjukkan dari rasa pahit dan licin.
Basa adalah senyawa kimia yang menyerap ion hidronium ketika dilarutkan dalam air. Basa memiliki pH lebih besar dari 7.
Basa digunakan dalam pembuatan sabun.
Senyawa Basa terbagi 2 yakni Basa kuat dan Basa Lemah
Basa kuat adalah senyawa yang terurai secara keseluruhan saat dilarutkan ke dalam air.
Contohnya: NaOH, KOH, Ba(OH)2
Asam kuat yaitu senyawa asam yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi asam kuat merupakan reaksi berkesudahan.
Basa lemah adalah senyawa yang hanya sedikit terurai saat dilarutkan ke dalam air.
Contohnya: NaHCO3, NH4OH
Asam lemah yaitu senyawa asam yang dalam larutannya hanya sedikit terionisasi menjadi ion-ionnya. Reaksi ionisasi asam lemah merupakan reaksi kesetimbangan.
C. Garam
Dalam ilmu kimia, garam ialah senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion), sehingga akan membentuk senyawa netral (tanpa bermuatan). Garam terbentuk dari hasil sebuah reaksi asam dan basa.
Secara kimia, asam dan basa saling berlawanan.
Juga sudah lama diketahui bahwa asam dan basa saling menetralkan membentuk garam.
Basa ialah zat(senyawa) yang bisa beraksi dengan asam dan menetralkannya , menghasilkan senyawa yang disebut garam. .
D. Indikator Asam Basa
Asam dan basa merupakan dua senyawa kimia yang sangat penting dalam kehidupan sehari-hari kita. Secara umum, zat–zat yang memiliki rasa masam itu mengandung asam, misalnya asam sitrat pada jeruk, asam asetat pada cuka makanan, serta asam benzoat yang digunakan sebagai pengawet makanan.
Kemudian, basa adalah senyawa yang mempunyai sifat licin, rasanya pahit seperti obat dan sabun, kemudian ada beberapa jenis basa yang bersifat korosif (penyebab karat) dan kausatik (merusak kulit).
Meskipun asam dan basa dapat dibedakan dari rasanya, tetapi tidak disarankan lho ya (dilarang) untuk mencicipi asam atau basa yang ada di laboratorium, berbahaya, nanti kamu kenapa-kenapa lagi, soalnya kandungannya itu beda.
Asam dan Basa dapat dibedakan melalui indikator asam basa, yaitu alat penguji asam basa dengan membandingkan pH nya.
Menurut Sorensen, pH merupakan fungsi logaritma negatif dari konsentrasi ion H+ dalam suatu larutan. Besaran pH digunakan untuk menunjukkan tingkat keaasaman dan kebasaan suatu larutan.
Pada larutan yang bersifat asam, harga pH < 7
Semakin kuat Asamnya maka pH nya akan mendekati 1, dan semakin lemah pHnya maka akan mendekati 7
Pada larutan yang
bersifat netral, harga pH = 7
Pada larutan yang bersifat basa, harga pH > 7
Semakin kuat Basanya maka pH nya akan mendekati 14, dan semakin lemah pHnya maka akan mendekati 7
Harga pH suatu larutan dapat diketahui dengan menggunakan pH-meter atau suatu indikator.
pH-meter
merupakan suatu rangkaian elektronik yang dilengkapi suatu elektrode yang dirancang khusus untuk dicelupkan
ke dalam larutan yang akan diukur.
Bila eklektrode kaca ini dimasukkan ke dalam larutan akan timbul beda
potensial yang diakibatkan oleh adanya ion H+ dalam larutan. Besar beda potensial ini menunjukkan angka
yang menyatakan pH larutan tersebut.
Selain pH-meter, pH suatu larutan dapat ditentukan pula dengan suatu indikator asam basa. Walaupun
bersifat kualitatif, indikator ini sering digunakan, karena dapat berubah warna dalam rentang pH yang relatif
kecil.
Perubahan warna suatu indikator melibatkan kesetimbangan antara bentuk asam dan bentuk basa dengan
warna yang berbeda.
Indikator terbagi atas 2 yakni indicator alami dan indicator buatan. Indikator alami seperti
kunyit dan Bunga kembang sepatu sedangkan contoh indicator buatan adalah metil, lakmus dan fenoftalein.
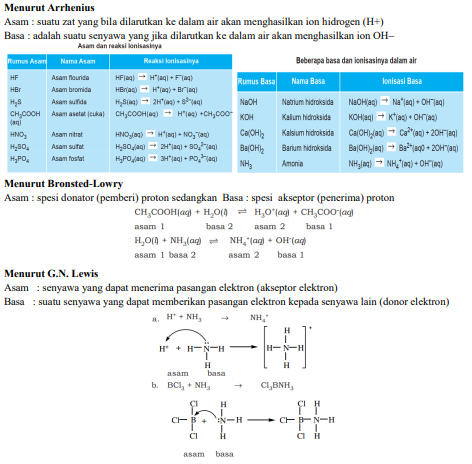
Konsep Asam Basa menurut para Ahli

Tidak ada komentar:
Posting Komentar